Quality by Design für Drug Delivery Systeme und Pharmaverpackungen
Die Qualitätsanforderungen für Drug Delivery Systeme, Pharmaprodukte und Kombinationsprodukte steigen kontinuierlich. Wir setzen daher bei unserem Qualitätsmanagement konsequent auf „Quality by Design“. Qualität wird bei diesem Konzept nicht mehr nach der Produktion durch Aussortieren fehlerhafter Teile sichergestellt, sondern von unserem Technical Competence Center bereits während der Entwicklungs- und Industrialisierungsphasen systematisch in Produkt und Prozessen verankert. Während aller Phasen des Produktentstehungsprozesses ist die Abteilung Qualitätssicherung eng mit allen anderen beteiligten Fachabteilungen verzahnt. Quality by Design ist auf diese Weise nicht nur der sicherste, sondern auch der wirtschaftlichste Weg, Drug Delivery Systeme, Kombinationsprodukte und Pharmaverpackungen auf den Markt zu bringen.
Unser Technisches Competence Center vereint alle Fachabteilungen der Produktentwicklung und Industrialisierung unter einem Dach: Programm-Management, Werkzeuge, Automation, Produkt- und Prozessentwicklung, Qualität und Kleinserienproduktion. Auf diese Weise fördern wir die intensive Zusammenarbeit zwischen Qualitätssicherung und den Fachabteilungen und ermöglichen ein lückenloses Qualitätsmanagement über den gesamten Produktentstehungsprozess - von der Idee bis zum serienreifen Produkt. Wir setzen dabei konsequent auf ein integriertes Quality by Design-Konzept, das die Gesamtkosten senkt, die Time to Market verkürzt, den Koordinationsaufwand minimiert und die Risiken bei Produkt und Projekt verringert.
 Quality management from the idea to the series production-ready product
Quality management from the idea to the series production-ready productDie Qualitätssicherung im TCC umfasst die Bereiche Quality Laboratory und Quality Engineering. Beide Bereiche arbeiten eng zusammen. Im Quality Laboratory befasst sich je eine Arbeitsgruppe mit
- materialspezifischen, physikalischen und chemischen Analysen von Rohstoffen (Kunststoffgranulaten) und Schadensanalysen bei produzierten Bauteilen, Baugruppen oder Medizinprodukten,
- entwicklungsbegleitenden, produktspezifischen Funktionsprüfungen,
- Qualifizierung und Validierung der dazu benötigten Messvorrichtungen und Messaufnahmen sowie (falls notwendig) der Messverfahren.
Funktionsprüfungen werden sowohl für Einzelteile als auch für Baugruppen durchgeführt. Für jede Funktionsprüfung werden dabei eine Prüfvorschrift erstellt und gemäß den Anforderungen des Kunden Akzeptanzkriterien festgelegt. Die Funktionsprüfungen sind Grundlage der Designverifizierung des Produkts, die vom Team Funktionsprüfungen durchgeführt wird. Abschließend werden die Ergebnisse vom für das Projekt zuständigen Qualitätsverantwortlichen aus dem Bereich Quality Engineering bewertet und freigegeben.
 Torque test of an inhaler
Torque test of an inhalerDer rote Faden für alle unsere Qualifizierungs- und Validierungsaktivitäten im Projekt ist der Validierungsmasterplan (VMP). Hier wird die gesamte Strategie für die Qualifizierung und Validierung der Betriebsmittel sowie der dazugehörigen Prozesse wie z.B. Spritzgusswerkzeuge, Montagelinien, Messmittel festgelegt und dokumentiert. Der VMP umfasst auch die Validierung externer Prozesse wie beispielsweise die Sterilisation oder andere ausgelagerte Prozesse. Erstellt wird der VMP vom Qualitätsverantwortlichen des Projekts in Zusammenarbeit mit den anderen Fachabteilungen.
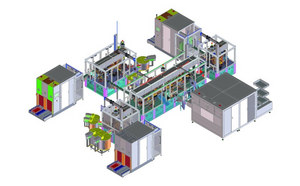 Production equipment design: complex assembly system for an inhaler
Production equipment design: complex assembly system for an inhalerDurch ein systematisches Risikomanagement werden
- Risiken, die von einem Produkt, Medizinprodukt oder Bauteil ausgehen können, identifiziert, analysiert und bewertet,
- die Auftretenswahrscheinlichkeit, Entdeckungshäufigkeit und die Schwere des Risikos bewertet und
- Maßnahmen zu deren Minderung erarbeitet, um die Risiken zu beherrschen.
Mit dem Risikomanagement wird bereits in einer frühen Phase des Produktentstehungsprozesses begonnen. Bereits in Phase I startet die Design-FMEA für das zu entwickelnde Produkt. Zuständig hierfür ist der Risk Manager / FMEA-Moderator im Bereich Quality Engineering. Er moderiert die FMEA und leitet das Risikomanagement-Team, bestehend aus je einem Vertreter aus den beteiligten Fachabteilungen Werkzeuge, Automation, Produkt- und Prozessentwicklung, Qualität und Program Management. Möglichst frühzeitig wird auch ein Vertreter des Produktionswerks, in dem das Produkt zukünftig in Serie hergestellt werden wird, hinzugezogen. Auf diese Weise wird bei den identifizierten potentiellen Fehlern und deren Risikobewertung das Know-how jeder Fachabteilung berücksichtigt. Zu Beginn wird entsprechend der internationalen Norm DIN EN ISO 14971 „Risikomanagement für Medizinprodukte“ ein Risikomanagement-Plan erstellt. Die Risikobetrachtung im Projekt umfasst neben der Design-FMEA auch FMEAs für den Herstellprozess (Spritzguss, Montage der Einzelteile bis zum fertigen Device), die Verpackung und eventuell Prozesse bei externen Dienstleistern oder den Transport. Abhängig vom Auftragsumfang der Kundenprojekte werden auch die Risiken bei der Anwendung von Medizinprodukten beim Patienten im Rahmen von User-FMEAs untersucht. Zur Dokumentation der FMEA verwenden wir die kommerzielle Software Scio PLATO.
 Risk management at Gerresheimer already begins at an early phase of the product origin process.
Risk management at Gerresheimer already begins at an early phase of the product origin process.Die Abteilung Quality Engineering arbeitet eng mit den Fachabteilungen Werkzeuge (Planung, Konstruktion, Bau und Qualifizierung von Spritzgießwerkzeugen) und Automation (Planung, Konstruktion, Bau und Qualifizierung von Montagelinien) zusammen. Der Vertreter des Quality Engineering gibt die von den Fachabteilungen erstellte Qualifizierungsdokumentation nach Prüfung frei und begleitet die FAT und SAT-Qualifizierungsläufe.
 Quality Engineering accompanies the FAT and SAT qualification runs
Quality Engineering accompanies the FAT and SAT qualification runsAus den Ergebnissen der Design- und Prozess-FMEA werden Prüfmaße und kritische Funktionen abgeleitet, die in die Prüfpläne eingehen. Vom Qualitätsverantwortlichen im Projekt werden dabei Prüfpläne für die Wareneingangsprüfung, die In-Prozess-Kontrollen während der Produktion und für die Endfreigabe erstellt. Im Anschluss wird in Zusammenarbeit mit dem Messraum und dem zukünftigen Produktionswerk eine Mess-Strategie entwickelt, die festlegt, welche Prüfmaße gemessen werden, wie diese gemessen werden sollen und welches Messmittel (optisch, taktil) dabei verwendet wird. Zur reproduzierbaren und wiederholbaren Messung von Teilen werden parallel Aufnahmen geplant, konstruiert, gebaut und qualifiziert. Die verabschiedete Mess-Strategie und die qualifizierten Vorlagen werden bei Projektübergabe an das Produktionswerk übergeben. Stellen unsere Kunden bei Industrialisierungsprojekten technische Zeichnungen zur Verfügung, werden auch diese vom Qualitätsmanagement geprüft.
 Measuring of components for an inhaler
Measuring of components for an inhalerAm Ende der Phase IV des Produktentstehungsprozesses wird nach erfolgreicher Qualifizierung und Validierung aller Betriebsmittel und Herstellungsprozesse das Product Master File (PMF) an das Produktionswerk übergeben. Das PMF wird im Bereich Quality Engineering erstellt. Es umfasst alle Dokumente, welche die Herstellung eines Produktes beschreiben. Neben einer detaillierten Produktbeschreibung sind im PMF beispielsweise alle notwendigen Betriebsmittel (Spritzgusswerkzeuge, Montagelinien, Messmittel) und deren Qualifizierungsdokumentation, die notwendigen Materialien und Zukaufteile oder externe Dienstleistungen, die Herstellprozesse sowie die Prüf- und die Verpackungsanweisungen abgelegt. Ein Product Master File wird für jedes entwickelte oder gefertigte Produkt erstellt. Nach Übergabe des PMF an das Produktionswerk wird dieses von den Mitarbeitern im Werk während des gesamten Produktlebenszyklus gepflegt und auf Stand gehalten.
 The Product Master File is kept up to date by Production employees during the entire product life cycle
The Product Master File is kept up to date by Production employees during the entire product life cycleDie Design-Verifizierung ist ein wichtiger Schritt bei der Entwicklung eines neuen Produktes. Sie ist der dokumentierte Beweis, dass alle für das Produkt im Pflichtenheft geforderten Funktionen erfüllt werden. Für jede der zu verifizierenden Funktionen werden dabei spezifische Testroutinen erarbeitet. Für die Design-Verifizierung werden vom Qualitätsmanagement in Zusammenarbeit mit der Entwicklungsabteilung ein Plan erstellt, Prüfvorschriften erarbeitet und die Testergebnisse in einem Design Verification Report dokumentiert.
 The design verification is an important step in the development of a new product
The design verification is an important step in the development of a new productEntwicklungsbegleitend können im Bereich Small Batch Produktion erste Muster hergestellt werden. Alle notwendigen Informationen wie zum Beispiel Prüfpläne und technische Zeichnungen werden der Produktion dabei von der Abteilung Quality Engineering übergeben. Die Fertigung von Musterteilen, Kleinserien oder Chargen für die Produktregistrierung werden von einem Mitarbeiter des Qualitätsmanagements überwacht.
 Clean room production according to ISO 14644-1 ISO class 8 of development samples, clinical samples, and small series
Clean room production according to ISO 14644-1 ISO class 8 of development samples, clinical samples, and small series