质量规划
质量源于设计——给药系统
随着时代的发展,人们对给药系统、药品包装和组合产品的质量要求不断提高。对于质量管理,我们始遵循 "质量源于设计"的理念。秉承着这一理念,我们认为,生产后通过分拣剔除出有缺陷的部件,不再是保证质量的万金法;只有在开发和工业化阶段通过技术能力中心系统性的质量保障设计,才能将“高质量”铭刻在产品和生产流程的DNA中。无论处于产品生产的哪一流程,质量保障部门均参与其中,并与其他相关部门紧密合作。如此践行"质量源于设计 "的理念,不仅是最安全的,也是将药品包装、制药设备和药品包装推向市场的最经济方式
格雷斯海姆为您赋能
质量源于设计:从创意到可批量生产的产品

我们的销售和工程中心以及技术能力中心将涉及产品开发和工业化的所有部门统合到一起,来共同进行:项目管理、产品和工艺开发、模具制造、自动化工程、产品和工艺开发、质量规划和小批量生产。通过这种方式,我们促进了质量保障部门与各部门之间的紧密合作,并在从创意到预备批量生产的整个产品问世流程中实现了无间隙的质量管理。在这个过程中,我们始终遵循综合的“质量源于设计”理念来降低总成本,缩短上市时间,尽量减少协调工作,降低产品和项目风险。
技术能力中心(TCC)的质量保障

技术能力中心的质量保障涵盖了质量实验室和质量工程领域方面的工作。这两个领域方面的工作密不可分。在质量实验室里,各工作组各司其职,分别负责
- 对原材料(塑料颗粒)进行特定物理和化学分析,对生产的部件、装配单元或医疗产品进行损坏分析,
- 在开发期间进行针对不同产品的功能性测试,
- 对为此目的所需的测量设备和测量记录以及测定方法(如有必要)进行认证和验证。
我们不仅为单个零部件制定功能性测试,也会为装配单元制定功能性测试。对此,我们为每种功能性测试都设置了特定的测试规格,并根据客户的验收标准要求进行设定。功能性测试是产品设计验证的基础,由功能性测试小组进行。测试结果将由质量工程部门里负责项目质量的人员进行评估和审批。
验证策略/验证总计划
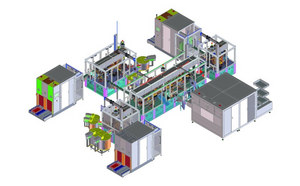
我们在项目中所有的认证和验证活动均按照验证主计划(VMP)进行。生产设备的认证和验证的完整策略,以及相关的流程,例如,注塑模具、装配线和测量设备,均在VMP中进行定义和记录。VMP还包括对外部流程的验证规定,例如,灭菌或其他外包流程。VMP由项目质量负责人与其他部门合作制定。
风险管理--识别、评估和控制风险

系统性风险管理
- 识别、分析和评估可能源于产品、医疗产品或组件的风险。
- 评估发生的概率、发现的频率以及风险的严重性,并在此基础上进行评估。
- 制订用于控制风险的风险降低措施。
风险管理在产品问世流程的早期阶段就已着手进行。待开发产品的设计FMEA已经于第一阶段开始进行。这项工作的负责人是质量工程领域的风险经理/FMEA主持人。他将主持FMEA并领导风险管理小组。该小组由产品和工艺开发、模具制造、自动化工程、质量和项目管理等相关部门各派一名代表组成。负责未来产品批量生产的生产工厂代表会在尽可能早的时间参与进来。
通过这种方式,每个部门的专有技术都可以被用于确定潜在错误及其风险评估。首先,根据国际标准DIN EN ISO 14971 "风险管理在医疗设备中的应用 "制定风险管理计划。除设计FMEA之外,项目中的风险考量还包括制造流程(注塑模具、成品设备的扩展部件的装配)、包装和潜在的外部服务提供商或运输环节所存在的流程中的风险。根据客户项目的范围,在用户FMEA的框架内,对医疗设备用于患者时的风险进行检验。我们使用商业软件Scio PLATO来记录FMEA。
对生产设备、工艺和测量设备进行认证和验证

质量工程部与模具制造部(注塑模具的规划、设计、建立和认证)和自动化工程部(装配线的规划、设计、建立和认证)紧密合作。质量工程部的代表审批各部门在测试后开具的资质认证文件,并跟进FAT和SAT资质认证。
选择和认证测量设备以及建立测量策略

测试的测量范围和关键功能取决于于设计和过程FMEA的结果,并归入测试计划。进货测试、过程中检验和最终批准的测试计划由项目质量负责人制定。之后,该负责人将与测量实验室和未来的生产工厂合作制定一套测量策略,确定将进行哪些测量,如何进行这些测量以及在此过程中使用哪些测量设备(光学、触感)。贮存场所的规划、设计、建立和认证与此并行,以便对部件进行可重复的测量。在项目移交时,商定的测量策略和合格模板将移交给生产设施。如果我们的客户提供工业化项目的技术图纸,这些图纸也将被质量管理部门测试。
创建产品主文件(PMF)

在产品问世流程的第四阶段结束时,在所有生产设备和制造流程被认证和验证为合格之后,产品主文件(PMF)将移交给生产设施。PMF由质量工程部门创建。它包括描述产品制造的所有文件。除了详细的产品描述外,PMF还包括,例如,所有必要的生产设备(注塑模具、装配线、测量设备)及其资质文件、必要的材料和购买的部件或外部服务、制造工艺,以及测试和包装说明。对于每个被开发或制造的产品,均需创建一个产品主文件。在将PMF移交给生产设施后,设施的员工将在整个产品生命周期中对其进行维护并保持更新。
设计验证
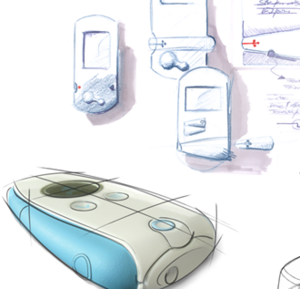
设计验证是开发新产品的一个重要步骤。它是一种记录在案的证明,用以证明产品规格中要求的所有功能都得到了满足。因此,需要为每个待验证的功能制定具体的测试程序。对于设计验证而言,质量管理部门会与开发部门协作制定计划和测试规定,并将测试结果记录在设计验证报告中。
小批量生产

在开发的同时,初始样品可以在小批量生产区域进行生产。为此,质量工程部门会将所有必要的信息,如测试计划和技术图纸等,移交给生产部门。产品注册所需的样品件、小批量或少批次的生产由质量管理部门的员工监督。

